
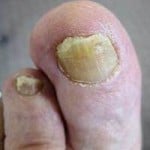
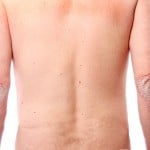
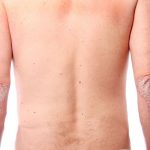
По данным исследований, проводимых в одной из клиник American Academy of Dermatology, San Francisko, у пациентов с диагнозом псориаз тяжелей формы наблюдалось полное исчезновение очагов поражения после терапевтического воздействия на интерлейкин -17 ингибитор. Действие Brodalumab на порядок превышает результаты применения иммуносупрессивного препарата Ustekinumab (Stelara).
По истечении 12 недель после начала лечения Brodalumab, у 44% рандомно выбранных пациентов, после применения двух доз препарата наблюдалось 100% улучшение в области поражения псориазом с индексом тяжести PASI 100 по сравнению с 22% пациентами со степенью тяжести течения заболевания PASI 75, получавших Ustekinumab.
«Продолжительность I периода наблюдения за пациентами, получающими Brodalumab, составила 52 недели», – говорит д-р Mark Lebwohl, профессор Icahn School of Medicine at Mount Sinai in New York City.
«Применение Brodalumab на II этапе привело к значительному клиническому улучшению у пациентов как с умеренной, так и с тяжелой формой поражения псориазом. Получая препарат в количестве 210 мг каждые 2 недели, мы продемонстрировали превосходство нового терапевтического средства над традиционным иммуносупрессивным препаратом Ustekinumab», – отметил д-р Lebwohl.
Brodalumab является первой и единственной в своем классе терапией, нацеленной на рецепторы интерлейкина-17. Являясь одним из нескольких противовоспалительных цитокинов, Brodalumab играет ключевую роль в патогенезе псориаза. Ustekinumab ингибирует активность двух других рецепторов заболевания, нацеленных на связывание цитокинов IL-12 и IL-23.
На III фазе испытаний Brodalumab продемонстрировал превосходство по сравнению с плацебо и Ustekinumab. Третья фаза включала 1831 рандомных пациента, разбитых на несколько групп. Спустя 12 недель индукционной терапии пациенты, получающие Brodalumab, были рандомизированы второй раз на четыре группы. Им было назначено к применению 140 или 210 мг Brodalumab каждые 2 недели, а также Ustekinumab и плацебо.
Большой неожиданностью в исследованиях II фазы стало внезапное увеличение скорости оседания кандидоза в 12 недель в brodalumab 210 мг группы, 1,4% против 0,6% в группе плацебо, сказал Lebwohl. К неделе 52, кандидоз произошло в 4% до 6,5% больных.
«Что касается уровня безопасности применения Brodalumab, то всеми членами исследуемых групп препарат переносится достаточно хорошо, и у меня есть все основания ожидать его дальнейшую хорошую переносимость пациентами», – констатировал д-р Mark Lebwohl в заключение.

 вопросы-ответы врача
вопросы-ответы врача








 68
68  0
0 